推荐产品
联系英硕医用包装
定制热线:15016844550
投诉建议:400-998-2901
电话:0769-85602287
传真:0769-85602207
QQ:2850517805
邮箱:yinso6@163.com
地址:东莞市大岭山镇梅林路59号
-
-
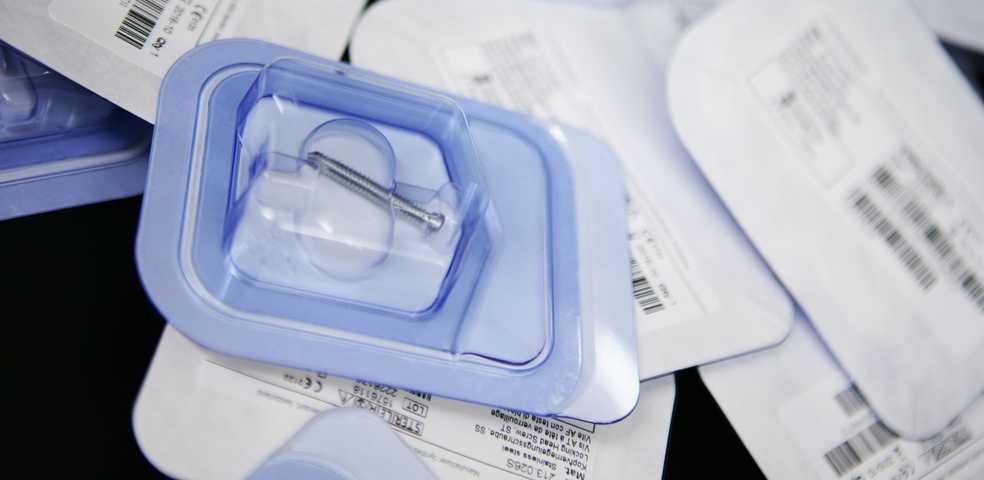
影响环氧乙烷灭菌效果的因素
以医用吸塑盒为例,它作为器械的初包装材料时。我们在设计之初就应在考虑到装配功能性,密封性,安全性,美观性的同时,注意预留EO的灭菌通道,使它在灭菌阶段能让EO气体穿透,从而达到预期的灭菌效果。
-
-
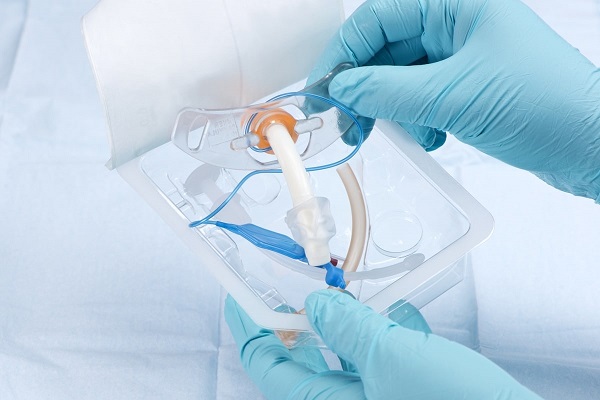
无菌包装材料的评估项目及测试方法参考
无菌屏障系统(SBS)是指防止微生物进入并能使产品在使用地点无菌取用的最小包装 , 它是预防感染的第一道防线。据数据表明,13%的召回与产品的包装有关,47%的无菌失效引起的召回原因与包装有关。因此,我们必须通过检验和提供客观证据确定某一具体的预期使用的特殊要求能得到持续满足。
-

-
影响医疗器械货架有效期的因素
在《无源植入性医疗器械货架有效注册申报资料指导原则中》提及到医疗器械的货架有效期是保证器械产品正常发挥预期功能的期限。一旦超过货架有效期,就意味着该器械产品在使用中具有潜在风险,可能不再满足性能指标和发挥预期用途。
-

-
《医疗器械初包装的生产环境要求》
医疗器械产品的生产过程必须满足《医疗器械生产质量管理规范》的要求,而医疗器械产品的包装作为生产过程中的重要环节,是关系产品质量的关键因素。
-
-
《最终灭菌医疗器械包装合规标准参考》
医用吸塑盒与Tyvek盖材的组合包装,作为一个常见的无菌屏障系统,既能保护、定位产品,方便储运,提升产品利于销售,还是一道重要的安全防线,直接影响到医疗器械产品的质量安全。
-

-
疫情期间,医用吸塑托盘整柜发往国外
2020年的春天,被口罩、防护服、额温枪等各种防疫物资占据着。经过两个多月的奋战,国内基本得到控制,但是国外疫情升降不一。截止2020年4月8日,全球确认病例超140万例。
-
-
开发与设计医疗包装要遵循哪些基本步骤
每一个生产商都应当确保在加工、贮存、处理以及配送的常见条件下,器械包装和运输容器的设计和制造能够保护器械,防止变形或受顺坏。在选择适合器械的、与器械的材料时,设计方面也会产生影响。
-

-
提供医疗器械吸塑盒时不可忽视的灭菌通道设计
因为医疗器械吸塑盒的前期设计决定了医疗器械产品的安全使用及有效性,切不可因一己之力贪图便宜,选择无资质无认证又无研发设计经验的三无厂家
-

-
医疗器械包装必备的三个基础条件
目前PETG是市场上公认满足以上三点要求的材料,完全符合ISO11607中微生物屏障系统要求。英硕包装合作过的客户上千家,见识过很多因为前期考虑成本问题导致包装不合规而重觅包装厂家的案例,得出的一个结论便是:最贵的成本就是包装失败。
-

-
目力检测医用包装的密封完整性
医用包装的密封完整性是直接关系到完整无菌屏障系统的有效性。它与加工工艺参数中的很多变量因素直接有关。如热压设备或者医用包装的原材料及环境(室内温度和相对湿度)。肉眼可见的密封特性和缺陷可为无菌包装的完整性和生产密封问题提供证据。
-
-
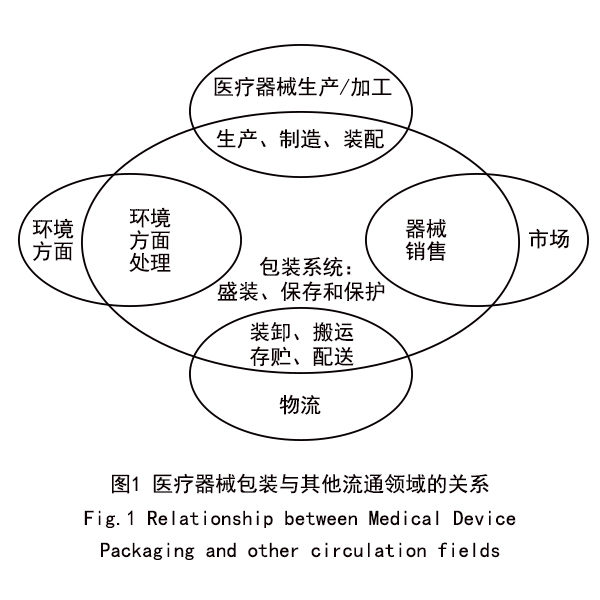
医疗器械包装与其他流通领域的关系
医疗器械包装在整个流通过程中占据很重要的作用。如前所说,医疗器械包装对卫生安全性要求较高,而流通领域的生产、加工、装卸、运输、存储、回收也对卫生安全性产生重要影响。
-

-
无菌医疗器械包装相关标准
医疗器械包装中两个最权威的标准是ISO11607(ISO,In-temational Standard Organization,国际标准化组织,日内瓦)和EN868(EN,European Committee for Standardization,有时也称CEN,欧洲标准化委员会,不录赛尔)系列。目前欧洲国家多数采用EN868系列,美国则主要采用FDA(FDA,Food and Drug Administration,美国食品和药品管理局)制定的相关标准。
-
-
无菌医疗器械包装的种类
根据器械使用的范围,国家药品监督管理局将医疗器械分为基础外科手术器械(6801)、显微外科手术器械(6802)、神经外科手术器械(6803)、眼科手术器械(6804)等(括号类数字为产品分类号)
-

-
医疗器械包装行业ISO3485认证与9001的区别
众所周知,ISO13485与ISO9001是医疗器械行业里必不可少的认证标准,ISO13485:2003又叫做“医疗器械质量管理体系”该标准是由SCA/TC221医疗器械质量管理和通用要求标准化技术委员会制定,是以IS09001:2000为基础的独立标准。
-

-
那些你可能不知道的医疗器械包装相关验证
医疗器械的包装设计必须在满足其用途的条件下,既能够确保内包装材料的符合性,又能确保其安全性。此文中英硕包装搜集了相关文羡标准让械企在对产品包装材料做相关验证时,可作为参考。YY/T 068.1 、YY/T 0313、YZB/国《体》产品注册标准、EN868-1、GB/T 16886.5-2003等。
-
-
特卫强包装-为您的医疗器械提供优质的灭菌保护
特卫强?现有三种型号用于灭菌包装领域:1073B,1059B和2FS?(4058B)。这些高质量的防护产品为医疗产品的包装和灭菌提供了更多的选择,为医疗器械提供了优异的灭菌后保护。特卫强?材料已广泛应用于灭菌医疗包装的所有领域,它已成为塑胶封袋、盖材、通气片和袋口的首选材料。目前使用特卫强?材料进行包装的产品包括有:人造血管、缝合线、心血管修补材料、无菌海绵、电外科附件、组织移植物等。
-
-
医疗器械灭菌包装密封性验证参考标准
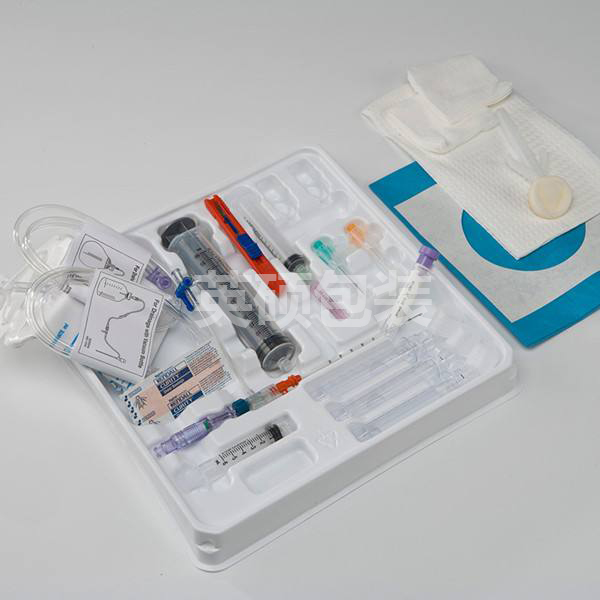
随着医疗器械对灭菌包装需求的不断扩大,质量和安全检验性也变得越来越严格。医疗器械灭菌包装(吸塑盒+特卫强盖材、纸塑袋等)作为直接与器械接触且用于阻隔微生物的一种包装形式。无论是何种形式的包装,都具备两个特性,可以满足灭菌操作并且在运输条件未使用前保持无菌状态。因此,相关部门开始重点加强关注灭菌包装的评审要求并且对其性能与质量做出具体的要求。
-
-
一次性医疗用品及无菌包装的存放问题
经过灭菌处理的包装叫做无菌包装,灭菌是指用物理或化学的方法杀灭微生物,包括致病和非致病微生物及细胞芽孢。
-

-
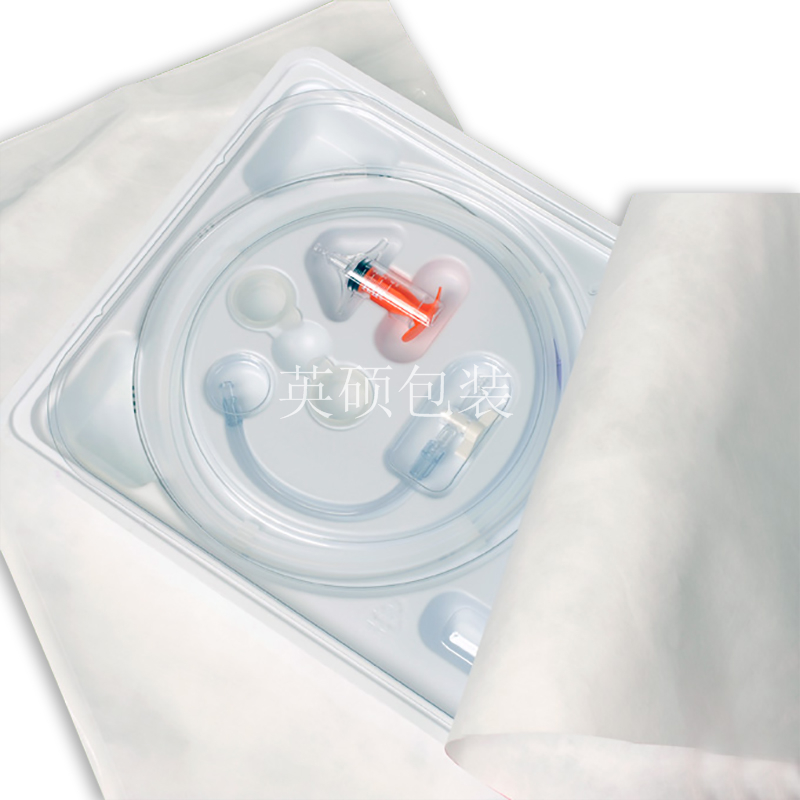
最终医疗器械灭菌包装材料的选择
医用包装的材料可以分为二类:重复使用包装和一次性包装材料。美国食品药品监督管理局(FDA)将无菌包装材料列为第二类(有潜在风险)的医疗器械。手术者使用受污染的医疗器械,其结果可能是致命的。因此,除了掌握如何构建无菌屏障系统保护产品免受污染的危害外,我们还要从原材料入手。
-
-
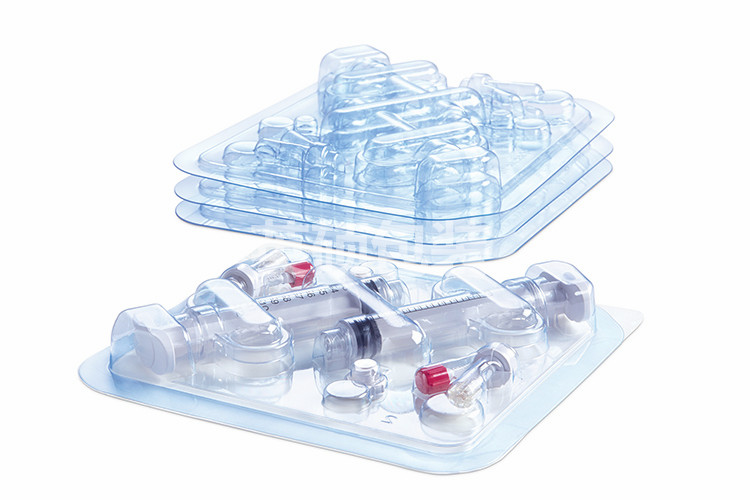
无菌包装医用特卫强材料可信赖防护
杜邦Tyvek 被视为用于无菌医疗包装的优质标杆材料,相对于其他的多孔性包装材料,为医疗器械和医疗用品提供了更高等级的无菌防护。









 粤公网安备 44190002005415号
粤公网安备 44190002005415号